4. CÉLZOTT TERÁPIÁK 
4.1 Molekuláris célzott terápiák („target terápia”)
4.1 MOLEKULÁRIS CÉLZOTT TERÁPIA EMLŐRÁKBAN
A molekuláris célzott terápia az elmúlt évtizedben vált az onkológiai gyakorlat mindennapos eszközévé. Alkalmazása megváltoztatta a daganatok eddig tapasztalt kórlefolyását; rendkívül költséges eljárás, mely nagy körültekintést, speciális diagnosztikát és hozzáértést igényel.
A molekuláris célzott/biológiai gyógyszerek a daganatért felelős részecskéket, molekulákat (amelyek vagy a daganatképződést segítő, „driver” génmutáció fehérjeterméke, vagy a daganatsejtek kóros gépezetének része) céloznak meg, befolyásolnak. Ezeket tudatosan, tudományos eredmények alapján fejlesztik ki, hatásuk relatíve kis dózissal is elérhető, kevéssé toxikusak; a legteljesebb hatás sokszor kemoterápiával, hormonterápiával, sugárterápiával vagy több molekuláris szer együttes kombinációjával érhető el.
A támadáspont lehet a daganatsejtben, vagy azon kívül, annak mikrokörnyezetében. A daganatsejteken kívül, vagy azok felszínén növekedési faktorokat, azok receptorait (4.1 ábra), sejtfelszíni antigéneket, a sejteken belül az üzenet átvitelben részt vevő molekulákat lehet megcélozni. Gátlásuk következtében a növekedés, osztódás üteme csökken, a pusztulás fokozódik, a terjedés, áttétképződés gátolt. Hasonló hatást okoz az érbenövés gátlás is. Ugyanarra a célpontra ma már akár több gyógyszert is kifejlesztettek, ezek mind hatásukban, mind mellékhatásukban különbözhetnek, ezért egyik vagy másik egyénileg előnyösebb lehet.
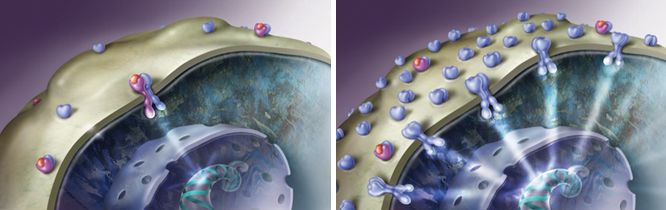
4.1 ábra A HER2 pozitív daganatsejtek felszínén a normálisan előforduló HER2 molekulák sokszorosa található, és ezek állandó serkentő stimulusokat küldenek a sejt belseje felé. A HER2 gátlás ezt akadályozza meg.
A molekuláris célzott szereket hatásmódjuk szerint is lehet csoportosítani. Lehetnek kismolekulájú szerek, amelyek könnyen behatolnak a sejtbe, és ott a „kiszemelt” molekulához kötődnek. Evvel a ráksejtek különféle kóros üzenet átviteli útvonalait gátolhatják. Az úgynevezett ellenanyagok a daganatsejteken kívül fejtik ki hatásukat. Ezeket a nagy fehérje molekulákat biológiai rendszerekben állítják elő, célpontjuk lehet a sejtfelszínhez kötött fehérje (receptor, antigén), vagy lehet a sejtközti térben, esetleg a keringésben (4.2 ábra). A célpont megkötése és közömbösítése révén egyrészt gátolja annak hatását, másrészt immunreakciót kelt, mely a daganatsejt halálát okozza.
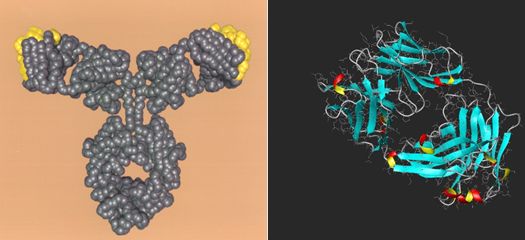
4.2 ábra Trastuzumab (Herceptin®, Roche) monoklonális HER2-ellenes ellenanyag
Újabb, szellemes megoldásként a rendkívül hatékony antitesthez kötött citosztatikum („antitest-gyógyszer konjugátum vagy angolul antibody-drug conjugate, ADC”) módszer szolgál, mely mivel a beadás után csak a daganatsejtnél fejti ki hatását, megkíméli a beteget a kemoterápia általános mellékhatásaitól. Fontos szem előtt tartani, hogy a molekuláris terápiák a rákra jellemző géneltérések következményeit, elsősorban a hibás fehérjéket, és nem a rákot okozó géneltéréseket célozzák meg. A génterápia, bár még nem alkalmazzuk széles körben, a kóros gént érintő beavatkozást jelent. Ez jövőbeni lehetőség, melyre bíztató eredmények állnak rendelkezésre.
A célzott terápia sem teljesen mentes a mellékhatásoktól, de eltér a kemoterápia, hormonterápia megszokott mellékhatásaitól; megfelelő dozírozással és megfelelő intézkedésekkel jól alkalmazhatók.
4.1 táblázat Emlőrákban alkalmazott regisztrált molekuláris célzott terápiák és előírt alkalmazási módjuk
|
Gyógyszernév |
Hatóanyag |
Csoport |
Célpont |
Emlőrák altípus |
Kötelező teszt |
Gyógyszer-forma |
Kombináció |
|
Herceptin |
trastuzumab |
HER-gátló ellenanyag |
HER2 |
HER2+ |
HER2 |
infúzió/in-jekció |
KT/HT |
|
Perjeta |
pertuzumab |
HER-gátló ellenanyag |
HER2 |
HER2+ |
HER2 |
infúzió |
KT/HT/MT |
|
Kadcyla |
trastuzumab-emtansin |
ADC |
HER2 |
HER2+ |
HER2 |
infúzió |
- |
|
Tyverb |
lapatinib |
kis molekula-súlyú HER2 gátló |
HER2 |
HER2+ |
HER2 |
tabletta |
KT/HT |
|
NERLYNX (FDA) |
neratinib |
kis molekula-súlyú HER2 gátló |
HER2 |
HER2+ |
HER2 |
tabletta |
KT/HT |
|
Avastin |
bevacizumab |
angiogenezis gátló ellenanyag |
VEGF-A |
ER-, PR-, HER2- |
ER, PR, HER2 |
infúzió |
KT |
|
Ibrance |
palbociclib |
CDK 4/ gátló |
CDK 4/6 |
ER/PR+, HER2- |
ER, PR, HER2 |
tabletta |
HT |
|
Kisqali |
ribociclib |
CDK 4/ gátló |
CDK 4/6 |
ER/PR+, HER2- |
ER, PR, HER2 |
tabletta |
HT |
|
Verzenio |
abemaciclib |
CDK 4/ gátló |
CDK 4/6 |
ER/PR+, HER2- |
ER, PR, HER2 |
tabletta |
HT |
|
Afinitor |
everolimus |
mTOR gátló |
mTORC1 |
ER/PR+, HER2- |
ER, PR, HER2 |
tabletta |
HT |
|
Piqray |
alpelisib |
PIK gátló |
PIK3CA |
ER/PR+, HER2- és PIK3CA mutáns |
ER, R, HER2, PIK3CA |
tabletta |
HT |
|
Lynparza |
olaparib |
PARP gátló |
PARP |
gBRCA mutáns |
gBRCA |
tabletta |
- |
|
Talzenna |
talazoparib |
PARP gátló |
PARP |
gBRCA mutáns |
gBRCA |
tabletta |
- |
ADC: antitest-gyógyszer konjugátum, ER: ösztrogén receptor, gBRCA: HER2: humán epidermális növekedési faktor-2, HT: hormonterápia, KT: kemoterápia,
MT: molekuláris célzott terápia, VEGF: vaszkuláris endotél növekedési tényező, PARP: poly adenozin-difoszfát ribose polymerase,
PIK3CA: foszfatidilinozitol-4,5 biszfoszfát-3kináz-katalitikus alegység
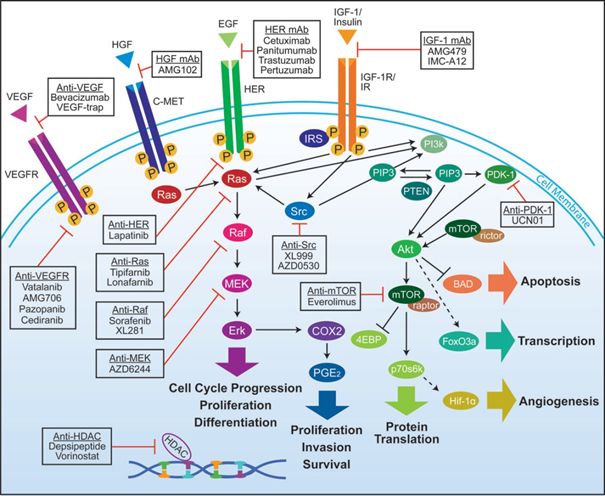
4.3 ábra Molekuláris célzott szerek és célpontjaik a sejtfelszínen és a sejten belül.
Az érbenövés gátló kezelések különféle mechanizmusokkal felfokozzák a kemoterápia hatását, ezért a két eljárás együtt alkalmazását megpróbálták mind korai, operálható, mind előrehaladott vagy áttétes emlőrákban. Jelenleg a bevacizumab (Avastin®, Roche) előrehaladott/áttétes hármas negatív („triple negatív”) emlőrákban támogatott lehetőség első vonalas kezelésként.
A daganatsejtek elleni védekezésben a veleszületett immunvédekezés és a szerzett, „adaptív” immunvédekezés, illetve ezek egymásra hatása egyaránt fontos szerepet játszik. A daganatok testidegen építőkövei, úgynevezett neoantigének immunválaszt váltanak ki, amennyiben nincsenek jelen ezt elnyomó tényezők. Az eredendő és adaptív immunrendszer normálisan folyamatosan ismeri fel és pusztítja el az élet folyamán keletkező ráksejteket. Az immunválaszt a számos immunsejt együttműködése, és az ezek vagy éppen a daganatsejt által elválasztott molekuláris tényezők segítik, vagy gátolják. A daganatellenes immunválaszt a daganat különféle immunszupresszív mechanizmusai gátolják, például a tumor gyenge antigenitása, rejtőzködése, és a daganat immunszupresszív hatása.
Az utóbbi évek legsikeresebb törekvése az immunmoduláló antitest terápia vagy immun checkpoint gátlók alkalmazása, mely forradalmasította az immunterápia gyakorlatát. Az immunterápia e lehetősége nem az immunrendszer serkentését célozza meg, hanem a normális immunreakció gátlását előidéző tényezők kiiktatását. Tehát az immun checkpoint gátlás a daganattal szemben kialakult immuntolerancia megszűntetését célozza, és eredményeképpen új egyensúlyi állapot alakul ki a daganatterhelés és az immunrendszer között. Ez szerencsés esetben olyan tartós javulást eredményez, amely hónapokig, több éven át tarthat, de egyelőre csak a betegek egy csoportjánál. A jelenleg alkalmazott checkpoint gátló terápia azoknál a daganatoknál válik be, amelyek testidegen fehérjéket, úgynevezett neoantigéneket fejeznek ki, illetve sok rendellenes gént tartalmaznak, ezt nevezzük nagy mutációs terhelésnek. A törekvés valamennyi daganatnál működhet, a kiindulási helytől függetlenül.
Az emlőrákok között először az ER, PR és HER2 negatív, úgynevezett hármas negatív vagy angolul „triple negative” altípusnál vált be az immun checkpoint gátló terápia.
A kezelés azokban az esetekben jön szóba, ahol a jó választ valószínűsítő molekuláris jellemzők kimutathatók.
Az immun checkpoint gátló terápiák hatását fokozhatja egyéb kezeléssel (például kemoterápia, sugárterápia, molekuláris szerek) történő kombinálásuk.
Az immun checkpoint gátló terápiák az esetek mintegy felében enyhébb vagy súlyosabb mellékhatásokat okoznak. Ezek immunológiai mellékhatások, a test saját fehérjéi ellen kialakuló fokozott immunreakció formájában. Bármelyik szervrendszerben jelentkezhetnek, leggyakrabban a bőrben (bőrgyulladás), a gyomor-bélrendszerben (például vastagbélgyulladás), vagy a hormontermelő szervek elégtelensége (például pajzsmirigy gyulladás) formájában. A komoly tüneteket okozó esetekben az immunterápiát fel kell függeszteni.
Az emlőrákok hármas negatív („triple negatív”) alcsoportjában alkalmazva az atezolizumab hatóanyag kemoterápiával együtt jelentősen javította a túlélést előrehaladott stádiumban az egyedüli kemoterápiával szemben, és a daganat PD-L1 pozitivitása esetén közel 10 hónappal megnyújtotta a túlélést (IMpassion130 vizsgálat). Hasonló esetekben a kombinált kezelés ma már rutinszerűen alkalmazható Magyarországon is (4.2 táblázat).
4.2 táblázat Immun checkpoint gátlók a gyakorlatban
|
Hatóanyagnév |
Kereskedelmi név |
Típus |
Célpont |
Javallat |
|
atezolizumab |
Tecentriq |
humanizált |
PDL-1 |
húgyúti daganatok, tüdőrák, emlőrák |
|
ipilimumab |
Yervoy |
humán |
CTLA4 |
melanoma |
|
nivolumab |
Opdivo |
humán |
PD-1 |
tüdőrák, melanoma, veserák, húgyúti daganatok, fejnyaki daganatok, vastagbélrák |
|
tremelimumab/ ticilimumab |
- |
human |
CTLA4 |
- |
|
cemiplimab |
Libtayo |
humán |
PD-1 |
bőr daganatok |
|
pembrolizumab |
Keytruda |
humán |
PD-1 |
tüdőrák, melanoma, veserák, húgyúti daganatok, fejnyaki daganatok, vastagbélrák MSI-H/TMB/PD-L1+ tumorok |
|
durvalumab |
Imfinzi |
humán |
PDL-1 |
húgyúti daganatok |
|
avelumab |
Bavencio |
humán |
PDL-1 |
Merkel-sejtes rák, hólyagrák |